Mecanismos del
asma
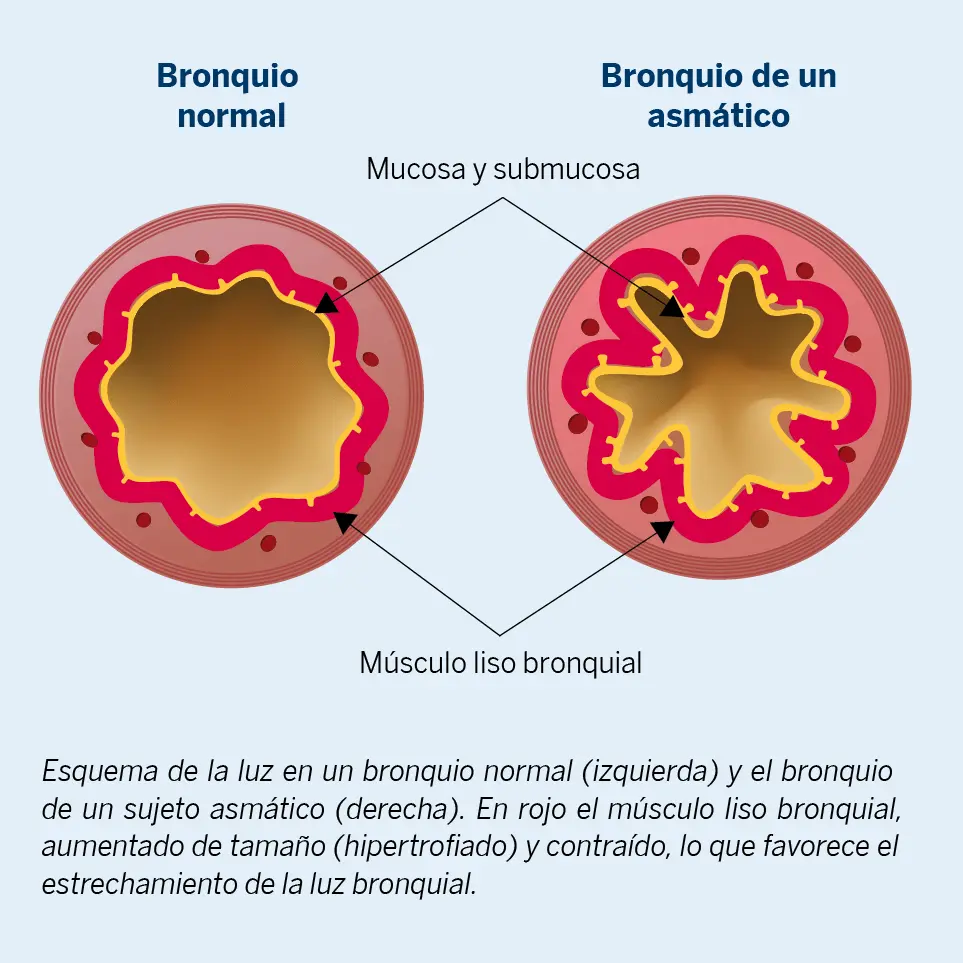
El asma es una enfermedad inflamatoria crónica de las vías
respiratorias que se caracteriza por la activación de los mastocitos, la
infiltración de eosinófilos, linfocitos T auxiliadores de tipo 2 y linfocitos
innatos de tipo 2. La activación de los mastocitos por alérgenos y estímulos
físicos libera mediadores de broncoconstricción, tales como histamina, LTD4 y
prostaglandina D2, que causan broncoconstricción, fuga microvascular y
exudación plasmática.
Acá les comparto un video orientado al mecanismos del asma: Mecanismos inmunológicos del asma.
Mecanismos de
la enfermedad pulmonar obstructiva crónica
La enfermedad pulmonar obstructiva crónica implica la
inflamación del tracto respiratorio con un patrón que difiere del asma. En la
COPD, hay un predominio de neutrófilos, macrófagos, linfocitos T citotóxicos y
linfocitos T auxiliadores tipo 17.
Vías de administración de fármacos a los pulmones.
La inhalación es el modo preferido de administración de
muchos medicamentos con un efecto directo en las vías respiratorias,
particularmente para el asma y la COPD. Es la única forma de administrar
algunos medicamentos.
Tamaño de la partícula: el tamaño de las partículas
por inhalación es de crucial importancia para determinar el sitio de depósito
en el tracto respiratorio. El tamaño óptimo para que las partículas se asienten
en las vías respiratorias es de 2-5 μm de MMAD.
Farmacocinética: del total del fármaco administrado,
sólo 10-20% ingresa a las vías respiratorias inferiores con un pMDI
convencional. Los fármacos se absorben del lumen de la vía aérea y tienen
efectos directos sobre las células blanco de las vías respiratorias.
Dispositivos para el suministro
Inhaladores presurizados de dosis medidas: los
medicamentos son impulsados desde un contenedor en el pMDI con la ayuda de un
propelente, anteriormente con un clorofluorocarbono, hoy en día reemplazado por
un HFA.
Vía oral
La teofilina se debe administrar por vía sistémica y los
corticosteroides pueden tener que administrarse por vía oral para enfermedades
pulmonares parenquimatosas.
La vía intravenosa debe reservarse para el suministro de
medicamentos en el paciente gravemente enfermo, que no puede absorber los
fármacos del tracto GI. Los efectos secundarios son por lo general frecuentes,
debido a las altas concentraciones plasmáticas.
Broncodilatadores
Los fármacos broncodilatadores relajan el músculo liso contraído de las vías respiratorias in vitro y provocan la reversión inmediata de la obstrucción de las vías respiratorias en el asma in vivo.
Les comparto un vídeo donde se explica a detalle sobre los fármacos broncodilatadores: Mecanismo de acción de los broncodilatadores.
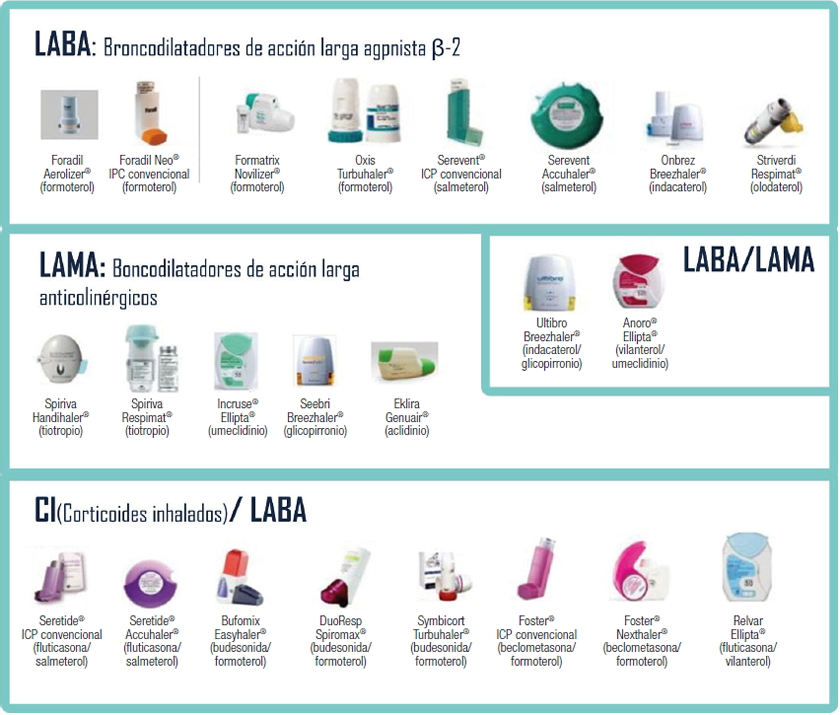
Las tres clases principales de broncodilatadores que están
en uso clínico en la actualidad son:
• Agonistas adrenérgicos β2 (simpaticomiméticos).
• Teofilina (una metilxantina).
• Agentes anticolinérgicos (antagonistas de los receptores
muscarínicos).
Agonistas adrenérgicos β2
Los agonistas β2 inhalados son el tratamiento broncodilatador de elección en el asma, porque son los broncodilatadores más eficaces y tienen efectos secundarios mínimos cuando se usan correctamente. Los agonistas β sistémicos, de acción corta y no selectivos, como el isoproterenol o metaproterenol, sólo se deben usar como último recurso.
Química: el desarrollo de agonistas β2 se basa en
sustituciones en la estructura de la catecolamina de norepinefrina y
epinefrina.
Modo de acción: la ocupación de receptores β2 por
agonistas da como resultado la activación de la vía Gs
-adenililciclasa-cAMP-PKA, dando origen a eventos de fosforilación que conducen
a la relajación del músculo liso bronquial.
Efectos antiinflamatorios: los efectos inhibidores de
los agonistas β2 sobre la liberación de mediadores por los mastocitos y la fuga
microvascular son antiinflamatorios, lo que sugiere que los agonistas β2 pueden
modificar la respuesta inflamatoria aguda. Los agonistas β2 no
parecen tener un efecto inhibidor significativo en la inflamación crónica de
las vías respiratorias de individuos asmáticos, la cual es suprimida por los
corticosteroides.
Uso clínico: los agonistas β2 de acción corta. Los
SABA inhalados son los broncodilatadores más utilizados y efectivos en el
tratamiento del asma, debido a su antagonismo funcional de la
broncoconstricción.
Los agonistas β2
inhalados de acción prolongada. Los LABA como el salmeterol, el formoterol y el
arformoterol han demostrado ser un avance significativo en el tratamiento del
asma y la COPD.
Inhaladores combinados: los inhaladores combinados
que contienen LABA y un corticosteroide como la fluticasona, salmeterol,
budesónida, formoterol se utilizan hoy en día ampliamente en el tratamiento del
asma y COPD.
Agonistas β2 estereoselectivos
El albuterol es una mezcla racémica de isómeros R-activos y S-inactivos. Aunque el R-albuterol más potente que el R/S-albuterol racémico en algunos estudios, las respuestas de dosis cuidadosas no mostraron ninguna ventaja en términos de eficacia y ninguna evidencia de que el S-albuterol sea perjudicial en pacientes asmáticos.
Efectos secundarios: los efectos secundarios no son
comunes con el tratamiento inhalado, pero son bastante frecuentes con la
administración oral o intravenosa. El temblor muscular debido a la estimulación
de los receptores β2 en el músculo esquelético es el efecto secundario más común,
también presenta taquicardia y las palpitaciones, la hipopotasemia es un efecto
secundario potencialmente serio y la pérdida de la relación
ventilación-perfusión V/Q.
Metilxantinas
Las metilxantinas, como la teofilina, que están relacionadas con la cafeína, se han usado en el tratamiento del asma y la teofilina. La teofilina se volvió más útil con la introducción de preparaciones de liberación lenta confiables.
Química: la teofilina es una metilxantina de
estructura similar a las xantinas dietéticas comunes: cafeína y teobromina.
Sólo dos parecen tener alguna ventaja sobre la teofilina: la enprofilina, que
es un broncodilatador más potente y puede tener menos efectos tóxicos; la
doxofilina, una nueva metilxantina disponible en algunos países, que tiene un
efecto inhibidor sobre las PDE similar al de la teofilina, pero que es menos
activa como antagonista de la adenosina y tiene efectos secundarios más
favorable.
Mecanismo de acción: el mecanismo de acción de la
teofilina es aún incierto. Además de su acción broncodilatadora, la teofilina
tiene muchos efectos no broncodilatadores que pueden ser relevantes para sus
efectos en el asma y la COPD.
Efectos no broncodilatadores: la teofilina tiene un
beneficio clínico en el asma y en la COPD a concentraciones plasmáticas de
menos de 10 mg/L, lo suficientemente bajas de tal manera que estos efectos son
poco probables.
Farmacocinética y metabolismo: la teofilina tiene
efectos antiasmático diferentes a la broncodilatación de forma que el
intervalo terapéutico considerado hoy en día es de 5-15 mg/L. La dosis de
teofilina que debe administrarse para proporcionar estas concentraciones
terapéuticas varía entre los sujetos, fundamentalmente debido a las diferencias
en la eliminación del medicamento. La teofilina se metaboliza en el hígado,
principalmente por CYP1A2; debido a las variaciones en la eliminación, es
necesario individualizar la dosis de teofilina.
Preparaciones y vías de administración: la
aminofilina intravenosa, un éster de etileno diamina de teofilina que es
soluble en agua, se ha utilizado durante muchos años en el tratamiento del asma
aguda grave. La dosis recomendada es de 6 mg/kg por vía intravenosa durante
20-30 min, seguida de una dosis de mantenimiento de 0.5 mg/kg por hora.
Uso clínico: en pacientes con asma aguda, la
aminofilina intravenosa es menos efectiva que los agonistas β2 nebulizados y,
por tanto, debe reservarse para los pacientes que no responden a los agonistas
β o no los toleran. La teofilina se ha utilizado como un controlador en el
tratamiento del asma leve persistente, aunque, por lo común, es menos efectiva
que las dosis bajas de ICS.
Efectos secundarios: los efectos secundarios más
comunes son dolor de cabeza, náuseas y vómitos debido a la inhibición de PDE4,
molestias abdominales e inquietud.
Antagonistas colinérgicos muscarínicos
Modo de acción: como antagonistas competitivos de la
ACh endógena en los receptores muscarínicos, estos agentes inhiben el efecto
directo del constrictor sobre el músculo liso bronquial mediado por la vía
M3-Gq-PLC-IP3-Ca2+. La eficacia se deriva del papel desempeñado por el sistema
nervioso parasimpático en la regulación del tono broncomotor.
Uso clínico: en pacientes asmáticos, los fármacos
anticolinérgicos son menos efectivos como broncodilatadores que los agonistas
β2 y ofrecen una protección menos eficiente contra los factores desencadenantes
bronquiales. Los anticolinérgicos se usan actualmente como un broncodilatador
adicional en pacientes asmáticos no controlados con LABA.
Antagonistas muscarínicos de acción prolongada
Varios LAMA ahora se han desarrollado a partir del
tratamiento de la COPD y, más recientemente, del asma grave. El bromuro de
tiotropio es un fármaco anticolinérgico de acción prolongada que es adecuado
para una dosis diaria como DPI o a través de un dispositivo mini nebulizador de
partícula pequeña, y fue más eficaz que el ipratropio administrado cuatro veces
al día en varios estudios; también reduce significativamente las
exacerbaciones.
β2 en pacientes con COPD, lo que ha llevado al desarrollo de combinaciones de dosis fijas. Las combinaciones de SABA/SAMA, como albuterol/ipratropio, son populares.
Efectos adversos: los fármacos anticolinérgicos
inhalados son generalmente bien tolerados. Al interrumpir la administración de
anticolinérgicos inhalados, se ha descrito un pequeño aumento de rebote en la
capacidad de respuesta de las vías respiratorias.
Nuevas clases de broncodilatadores
Sulfato de magnesio (MgSO4): es útil como broncodilatador
adicional en niños y adultos con asma aguda grave. El MgSO4 intravenoso o
nebulizado beneficia a adultos y a niños con exacerbaciones graves.
Fármacos que abren los canales de K+: los fármacos
que abren los canales de K+ como el cromakalim o el levcromakalim la forma
isomérica levo de cromakalim abren los canales de K+ dependiente de ATP en el
músculo liso, lo que conduce a la hiperpolarización de la membrana y la
relajación del músculo liso de las vías respiratorias.
Análogos de polipéptidos intestinales vasoactivos: el
polipéptido intestinal vasoactivo es un péptido de 28 aminoácidos que se une a
dos GPCRs , VPAC1 y VPAC2, los cuales se unen principalmente a Gs para
estimular la vía de adenililciclasa-cAMP-PKA que conduce a la relajación del
músculo liso. El VIP es un potente dilatador del músculo liso de las vías
respiratorias humanas in vitro, pero no es eficaz en los pacientes.
Agonistas del receptor del gusto amargo: los
receptores de sabor amargo son GPCR que se expresan en el músculo liso de las
vías respiratorias y median la broncodilatación en respuesta a agonistas, como
la quinina y la cloroquina, incluso después de la desensibilización del
receptor β2.
Corticosteroides
Mecanismo de acción: los corticosteroides entran en
las células blanco y se unen a los GR en el citoplasma. Sólo hay un tipo de GR
que se une a los corticosteroides y no existen pruebas de la existencia de
subtipos que puedan mediar en diferentes aspectos de la acción de los
corticosteroides.
Efectos antiinflamatorios en el asma: los
corticosteroides tienen efectos amplios en la transcripción génica, lo que
aumenta la transcripción de varios genes antiinflamatorios y suprime la
transcripción de muchos genes inflamatorios.
Efecto sobre la respuesta a los adrenérgicos β2: los
esteroides potencian los efectos de los agonistas β en el músculo liso
bronquial y previenen y revierten la desensibilización del receptor β en las
vías respiratorias in vitro e in vivo. A nivel molecular, los corticosteroides
aumentan la transcripción de los genes de receptores β2 en el pulmón humano in
vitro y en la mucosa respiratoria in vivo, y también aumentan la estabilidad de
su RNA mensajero.
Farmacocinética: los ICS es importante en relación
con los efectos sistémicos. La fracción de esteroides que se inhala hacia los
pulmones actúa localmente en la mucosa de las vías respiratorias, pero puede
absorberse desde las vías respiratorias y la superficie alveolar. El
dipropionato de beclometasona y la ciclesonida son profármacos que liberan el
corticosteroide activo, después de que el grupo éster se escinde por esterasas
en el pulmón.
Vías de administración y dosificación
Corticosteroides inhalados en la COPD: los pacientes
con COPD a veces responden a esteroides, y es probable que estos pacientes
tengan asma concomitante. Los corticosteroides no parecen tener ningún efecto
antiinflamatorio significativo en la COPD; al parecer hay un mecanismo de
resistencia activo, que puede explicarse por la afectación de la actividad de
HDAC2 como resultado de la tensión oxidativa.
Esteroides sistémicos: los esteroides intravenosos
están indicados en el asma aguda, si la función pulmonar se predice en menos de
30%, y en pacientes que no muestran una mejoría significativa con el agonista
β2 nebulizado. La hidrocortisona es el esteroide de elección, porque tiene el
inicio más rápido, en comparación con 8 h de la prednisolona. La
metilprednisolona también está disponible para uso intravenoso.
Efectos adversos: los corticosteroides inhiben la
secreción de corticotropina y cortisol por un efecto de retroalimentación
negativa sobre la glándula hipófisis. Los efectos secundarios del tratamiento
con corticosteroides orales a largo plazo incluyen retención de líquidos,
aumento del apetito, aumento de peso, osteoporosis, fragilidad capilar,
hipertensión, úlcera péptica, diabetes, cataratas y psicosis.
Cromones
Cromolyn sodium es un derivado de la khella, un remedio
herbolario egipcio, del cual se descubrió que protege contra la exposición a
alérgenos sin ningún efecto broncodilatador. Se desarrolló un fármaco
estructuralmente relacionado, el nedocromil sódico, que tiene un perfil
farmacológico similar al del cromoglicato.
Les comparto un video orientado al tratamiento de cromones: Cromones tratamiento para el asma.
Inhibidores de
la fosfodiesterasa
Los inhibidores de la PDE relajan el músculo liso e inhiben
las células inflamatorias a través de un aumento en el cAMP celular. La PDE4 es
la isoforma de PDE predominante en células inflamatorias, incluidos los
mastocitos, los eosinófilos, los neutrófilos, los linfocitos T, los macrófagos
y las células estructurales, tales como nervios sensoriales y células
epiteliales, lo que sugiere que los inhibidores de PDE4 podrían ser útiles como
un tratamiento antiinflamatorio, tanto en el asma.
Antagonistas de mediadores
Tanto los antihistamínicos H1 como los antiLT se han
aplicado a la enfermedad de las vías respiratorias, pero su beneficio adicional
sobre los agonistas β2 y los corticosteroides es leve.
Antihistamínicos: la histamina imita muchas de las
características del asma y se libera de los mastocitos en las respuestas
asmáticas agudas, lo que sugiere que los antihistamínicos pueden ser útiles en
la terapia del asma.Los antihistamínicos más nuevos, que incluyen la cetirizina
y la azelastina, tienen algunos efectos beneficiosos.
Antileucotrienos: existe evidencia de que en el asma se producen
LTc-cis y que tienen efectos potentes sobre la función de las vías
respiratorias, induciendo broncoconstricción, hiperreactividad de las vías
respiratorias, exudación plasmática, secreción de moco e inflamación eosinofílica.
Estos hallazgos condujeron al desarrollo de inhibidores de la enzima
5’-lipooxigenasas y varios antagonistas de los receptores cis-LT1, que incluye
montelukast, zafirlukast y pranlukast.
Tratamientos
inmunomoduladores
Tratamiento de inmunodepresión
Tratamiento contra los receptores de IgE
El aumento de IgE específica es una característica
fundamental del asma alérgica. El omalizumab es un anticuerpo monoclonal
humanizado que bloquea la unión de IgE a los receptores de IgE de alta afinidad
en los mastocitos y, por tanto, evita su activación por alérgenos, bloquea la
unión de IgE a los receptores de IgE de baja afinidad en otras células
inflamatorias, incluidos linfocitos T y B, macrófagos y, posiblemente,
eosinófilos, para inhibir la inflamación crónica.
Inmunoterapia específica
Aunque la inmunoterapia específica es efectiva en la rinitis
alérgica debida a alérgenos únicos, existe poca evidencia de que las
inyecciones de desensibilización a alérgenos comunes sean efectivas para
controlar el asma crónica.
Nuevos fármacos
en desarrollo para la enfermedad de las vías respiratorias
Nuevos antagonistas de mediadores
El antagonismo de los receptores o de la síntesis de
mediadores inflamatorios es un método lógico para el desarrollo de nuevos
tratamientos para el asma y la COPD.
Antagonistas de CRTh2
El factor quimiotáctico para las células TH2 se ha
identificado como prostaglandina D2, que actúa sobre un receptor DP2. Varios
antagonistas de DP2/CRTh2 están actualmente en desarrollo para el asma, con
algunos resultados iniciales prometedores en pacientes con inflamación
eosinofílica.
Antioxidantes
La tensión oxidativa es importante en el asma grave y la
COPD, y puede contribuir a la resistencia a los corticosteroides. Los
antioxidantes existentes incluyen vitaminas C y E y N-acetilcisteína. Estos
fármacos tienen efectos débiles, pero se están desarrollando antioxidantes más
potentes, incluidos los activadores del factor de transcripción Nrf2.
Modificadores de la citocina: las citocinas
desempeñan una función crítica en la perpetuación y amplificación de la
inflamación en el asma y la COPD, lo que sugiere que las anticitocinas pueden
ser beneficiosas como terapia.
Antagonistas de los receptores de quimiocinas
Muchas quimiocinas participan en el asma y la COPD y
desempeñan una función fundamental en el reclutamiento de células inflamatorias
hacia los pulmones, como eosinófilos, neutrófilos, macrófagos y linfocitos. Los
receptores de quimiocinas son objetivos atractivos, porque son GPCR;
inhibidores de moléculas pequeñas están en desarrollo.
Inhibidores de la proteasa
Varias enzimas proteolíticas están involucradas en la
inflamación crónica de las enfermedades de las vías respiratorias. La triptasa
de los mastocitos tiene varios efectos sobre las vías respiratorias, que
incluyen el aumento de la capacidad de respuesta del músculo liso de las vías
respiratorias a los constrictores.
Nuevos medicamentos antiinflamatorios
Inhibidores de NF-κB : el NF-κB desempeña un papel
importante en la orquestación de la inflamación crónica; muchos de los genes
inflamatorios que se expresan en el asma y la COPD están regulados por este
factor de transcripción.
Inhibidores de proteína cinasa activados por mitógeno:
las vías de MAP cinasa están involucradas en la inflamación crónica. Ha habido
un interés particular en la vía p38 de MAP cinasa, que está bloqueada por una
nueva clase de fármacos, como el losmapimod.
Antitusígenos
A pesar de que la tos es un síntoma común de la enfermedad
de las vías respiratorias, sus mecanismos son poco conocidos y el tratamiento
actual es insatisfactorio.
Acá les comparto un vídeo donde se explica los antitusígenos: Antitusígenos.
Opiáceos: tienen un mecanismo central de acción en
los MOR en el centro de la tos medular, pero existe cierta evidencia de que
pueden tener acción periférica adicional sobre los receptores de la tos en las
vías respiratorias proximales. La codeína y la folcodina se usan comúnmente,
pero existen pocas pruebas de que sean clínicamente efectivas. La morfina y la
metadona son efectivas, pero están indicadas sólo para la tos intratable
asociada con el carcinoma bronquial.
Dextrometorfano: es un antagonista de los receptores
NMDA con actividad a nivel central. Se usa comúnmente para tratar la tos, es
poco efectivo. En niños con tos nocturna aguda, no es significativamente
diferente del placebo en la reducción de la tos.
Fármacos para
la disnea y el control ventilatorio
Fármacos para la disnea
Los broncodilatadores deberían reducir la dificultad respiratoria en pacientes con obstrucción de vía aérea. Los fármacos que reducen la disnea también pueden deprimir simultáneamente la respiración y, por tanto, son peligrosos en el asma grave y la COPD.
Estimulantes ventilatorios: selectivos se indican si
hay alteración en la ventilación como consecuencia de sobredosis con sedantes,
depresión respiratoria post anestésica e hipoventilación idiopática.
Doxapram: el uso de doxapram para tratar la
insuficiencia respiratoria en COPD ha sido en gran parte sustituido ahora por
la ventilación no invasiva.
Almitrina: estimula la ventilación sólo cuando hay
hipoxia.
Acetazolamida: induce acidosis metabólica y así
estimula la ventilación, pero no se utiliza de manera amplia, porque el
desequilibrio metabólico que produce puede ser nocivo en casos de acidosis
respiratoria. Tiene muy poco efecto beneficioso en la insuficiencia respiratoria
en pacientes con COPD
Naloxona: es un antagonista opioide competitivo que
se indica únicamente si la depresión ventilatoria se debe a la sobredosis de
opioides.
Flumaznil: es un antagonista de los receptores de
benzodiazepinas que puede revertir la depresión respiratoria debida a
sobredosis de benzodiazepinas.
Bibliografía
Goodman &
Gilman. Las Bases Farmacológicas de la
Terapéutica Ed.13
Autores: , Björn C. Knollman





Muy bueno informase de esto
ResponderEliminarMe parece interesante
ResponderEliminarMe parece interesante debido a que yo tengo conocidos que padecen de eso
ResponderEliminarOhhh interesante de saber
ResponderEliminarEs muy útil este tipo de información. Más cuando tienes algún familiar que padece de ello.
ResponderEliminarMe parece excelente el que se comparta información sobre este tema tomando en cuenta que en nuestro contexto actual en lo que se refiere a calidad del aire en nuestras metrópolis se puntúa muy bajo y por ende en años recientes el número de personas que padecen de afecciones respiratorias va en aumento a un ritmo alarmante.
ResponderEliminarQue importe saber estas cosas más teniendo familiares con estos problemas
ResponderEliminarMuy bien explicado, es interesante saber de eso puesto que cualquiera puede padecer de ello
ResponderEliminar